

来源: 思宇MedTech 2022年07月11日 14:00
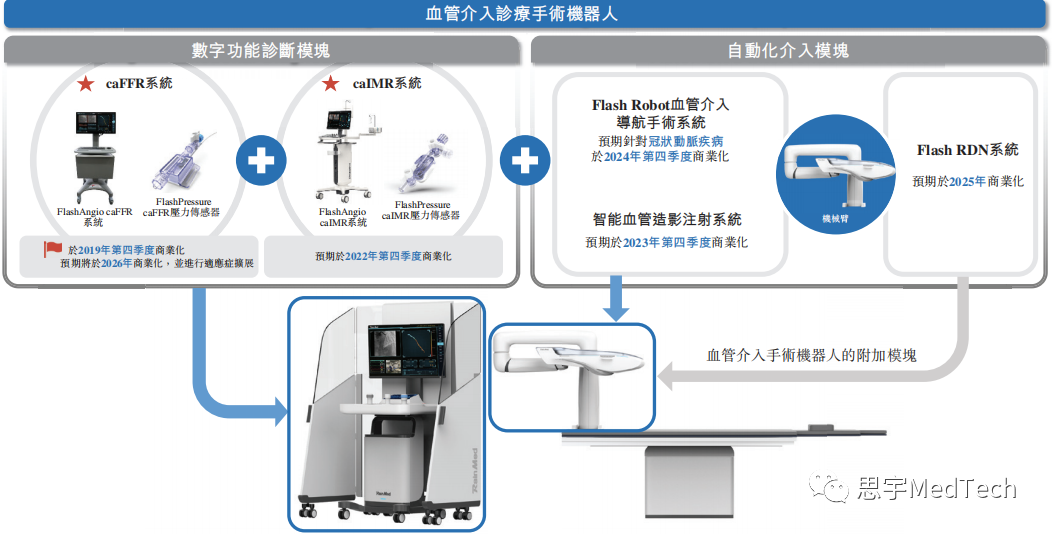
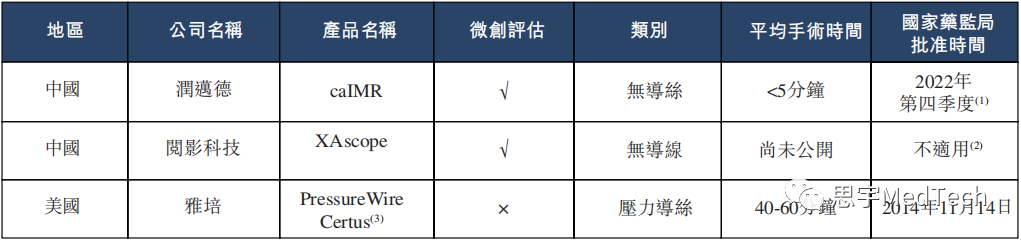
01 润迈德成立于2014年,致力成为全球领先的血管介入手术机器人公司,目前专注于基于冠状动脉造影的血流储备分数系统(caFFR系统)及基于冠状动脉造影的微血管阻力指数系统(caIMR系统)的设计、开发及商业化。 其核心产品(即caFFR系统及caIMR系统)是创新的医疗器械,用于评估冠状动脉狭窄和微循环功能障碍(冠状动脉疾病CAD的相关起因)引起的心肌缺血的严重程度,其设计旨在替代压力导丝的使用,大幅减少技术误差风险和操作时间,从而改善生理评估。 这两个系统目前均单独用于CAD的精准诊断。由于FFR测量动脉的宏观循环(占所有动脉5%),而IMR则测量动脉的微观循环(占所有动脉95%),因此联合使用IMR和FFR可为CAD患者的冠状动脉血液流通状况提供全面评估。该两个系统有望成为公司未来血管介入手术机器人的核心及关键模块。 (1)润迈德产品及在研产品的开发情况 ★ 核心产品 ▲ 此款器械根据国家药监局颁布的《免于临床评价医疗器械目录》将豁免进行临床试验。 (数据来源:招股说明书) (2)公司拟在未来打造血管介入手术机器人的路线图 借助caFFR系统及caIMR系统作为核心及关键诊断模块,公司的最终使命为生产业界领先的血管介入手术机器人,其将具备血管造影成像、功能精准诊断和手术导航以及外科手术等全套功能,可应用于包括冠状动脉和高血压在内的不同血管疾病领域。 血管介入手术机器人是一个一站式混合程序,通过连接及整合所有临床应用领域进行诊断和治疗 (预期于2024年第四季度推出市场) (数据来源:招股说明书) 02 公司于2019年10月启动出售caFFR系统。 2020年及2021年: ①公司的营收分别为610万元、8120万元人民币,毛利分别为526万元、6903万元,毛利率分别为86.3%、85%; ②公司对五大客户的销售分别为人民币4.9百万元及人民币31.0百万元,分别占公司各年内总收入的79.6%及38.2%; ③公司对最大客户的销售额分别为人民币2.9百万元及人民币11.7百万元,分别占各年收入的48.3%及14.4%。 (1)2020年五大客户的销售概况: (2)2021年五大客户的销售概况: 03 (1)FFR测量产品在中国的竞争格局 附注: (1)由于传统基于导丝的FFR测量(如雅培、飞利浦及波士顿科学的基于导丝的产品)被视为参考测量标准,故理论上被定义为准确率100%的诊断标准。诊断准确率乃通过与基于导丝的FFR结果比较而计算。 (2)此处所载定价资料乃由灼识咨询根据专家访谈、截至最后实际可行日期相关产品在中国超过15个省份以及省级及地区政府采购平台的公开批发招标价格而提供。该等产品的价格或会变动,而我们无法控制有关变动。 (3)博动医学的FFR测量产品的价格乃基于其以销售控制台为主的业务模式,并在较小程度上来自于提供技术服务。 (4)飞利浦及波士顿科学的FFR控制台是一体机,可测量FFR及IVUS。 *基于CTA的FFR测量产品为基于软件的产品,且因此并无配备控制台或耗材。根据灼识咨询的资料,患者就每次基于CTA的FFR测量支付的服务费约为人民币1,700元至人民币1,900元。 **基于OCT的FFR最近方获批准。该产品的价格尚未公开。 资料来源:国家药监局;ClinicalTrials;专家访谈;公司网站;灼识咨询分析 (数据来源:招股说明书) (2)IMR测量产品在中国的竞争格局 在中国,IMR测量市场尚处于早期发展阶段。目前有一款IMR产品获得国家药监局批准,即雅培的压力导丝产品PressureWire Certus;两款IMR在研产品(包括润迈德的caIMR系统)已在全球范围完成确证性临床试验,并有望成为全球首个获准进行商业化的微创IMR系统。 附注: (1) caIMR预期将于2022年第四季度获国家药监局批准。 (2) XAscope预期于2022年12月完成临床试验。 (3) IMR测量功能是PressureWire Certus适应症的扩展,其主要作研究用途,其在中国的零售价尚未公开。 资料来源:国家药监局;ClinicalTrials;专家访谈;公司网站;灼识咨询分析 (数据来源:招股说明书)






本文著作权属原创者所有,不代表本站立场。我们转载此文出于传播更多资讯之目的,如涉著作权事宜请联系删除。